澱粉をこわす酵素はアミラーゼといいます。だ液にアミラーゼが含まれていることはよく知られていますが、澱粉の加工などの工業的によく使われているアミラーゼの多くは、微生物から得られたものです。実は、アミラーゼとひとくちに言っても、たくさんの種類が知られています。ここでは、アミラーゼがどのようなかたちをしているのか見てみましょう。
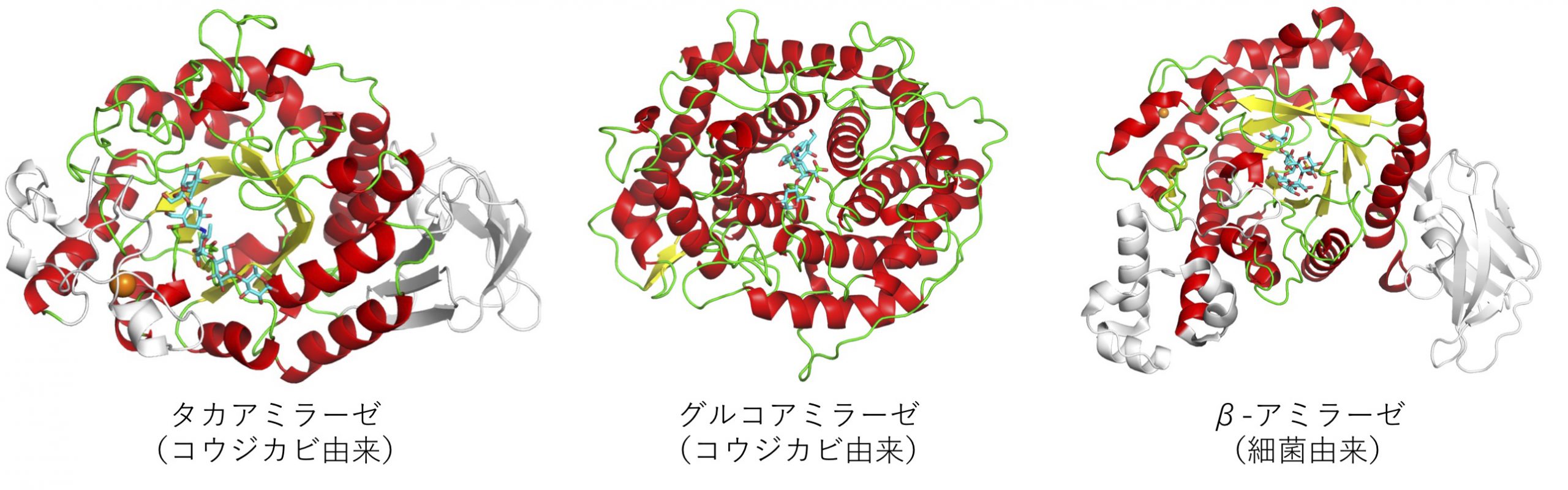
図の左は、コウジカビのタカアミラーゼの立体構造です。タカアミラーゼは、高峰譲吉博士のタカジアスターゼの主成分でもあり、澱粉工業において最も多く使われています。タカアミラーゼは、丸くならんだ8本のβ-シート(黄色の矢印)のまわりを8本のα-ヘリックス(赤色のリボンのようならせん)が囲んだ、たるのようなかたちをしています。タカアミラーゼは、澱粉の鎖(図では水色の棒で表しています)を真ん中から切ってばらばらにすることで、分解していきます。
図の真ん中には、同じくコウジカビから得られたグルコアミラーゼ、右には、細菌のβ-アミラーゼを示しています。これらの酵素はタカアミラーゼとは異なったやりかたで澱粉を分解します。β-アミラーゼは、タカアミラーゼと似たかたちをしていますが、グルコアミラーゼは、α-ヘリックスだけでできています。
タカアミラーゼの立体構造を世界で初めて明らかにしたのは、大阪大学の松浦良樹博士らであり、β-アミラーゼの立体構造も日本のグループにより明らかにされました。酵素のかたちを三次元で明らかにすることにより、澱粉工業だけでなく、医薬品の開発など、さまざまな役に立つ情報が得られます。
東京大学 大学院農学生命科学研究科
伏信進矢
